N°6, Août 2017
Dans cet article, bien que n’étant ni médecin, ni pharmacien, ni même soignant, je vais exposer le cas du Lévothyrox (médicament utilisé lors d’une hypothyroïdie ou pour diminuer la sécrétion de TSH, une hormone de stimulation de la thyroïde), qui concerne près de 3 millions de patients (selon les dernières données 2012 de l’ANSM, Agence Nationale de Sécurité du Médicament) et qui a déjà fait parler de lui il y a quelques années lorsque le laboratoire s’est retrouvé en rupture de stocks.
La polémique actuelle illustre l’adage selon lequel le mieux est l’ennemi du bien.
Exposé des faits :
L’Agence nationale de sécurité du médicament et des produits de santé [ANSN, créée par la loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire des médicaments et des produits de santé, se substituant le 1er mai 2012 à l’Agence française de sécurité sanitaire du médicament et des produits de santé (Afssaps) dont elle a repris les missions, droits et obligations], publie une communication le 3 mars 2017 pour informer d’un changement de formule et de couleur des boîtes Lévothyrox, ainsi :
« Afin de garantir une stabilité plus importante de la teneur en substance active (lévothyroxine) tout le long de la durée de conservation du médicament, le laboratoire Merck a réalisé, à la demande de l’ANSM, une modification de la formule de Levothyrox.
La substance active reste identique. Cette nouvelle formule sera mise à disposition dans les pharmacies à compter de la fin du mois de mars 2017. Ces modifications ne changent ni l’efficacité ni le profil de tolérance du médicament.
Toutefois, par mesure de précaution face à toute modification, et bien que la bioéquivalence entre l’ancienne et la nouvelle formule ait été démontrée, l’ANSM préconise, pour certains patients, de réaliser un dosage de TSH quelques semaines après le début de la prise de la nouvelle formule.
Par ailleurs, les couleurs des boîtes et des blisters vont être modifiées: une attention particulière des professionnels de santé et des patients devra être portée lors de la phase de transition pour éviter les erreurs.«
Les changements effectués ont été les suivants :
- Suppression du lactose, présenté comme un excipient à effet notoire, qui a été remplacé par le mannitol, qui contrairement au lactose est dépourvu d’effet notoire à la dose où il est présent dans les comprimés et ce quel que soit le dosage du médicament.
- Ajout de l’acide citrique anhydre, excipient très répandu dans la composition des médicaments et dans le domaine alimentaire, utilisé en tant que conservateur pour limiter la dégradation de la lévothyroxine au cours du temps.
Ces modifications ont été demandées pour garantir une teneur en substance active (la lévothyroxine) plus constante d’un lot à l’autre, ou au sein d’un même lot, et ce pendant toute la durée de conservation du produit.
L’ANSM s’est faite remarquée par son insuffisance dans le procédé de diffusion de cette information importante :
Il ne s’agit pas dans cet article, d’énoncer des effets indésirables du médicament actuel, ni d’apporter une analyse sur l’efficacité pharmacologique ou d’apporter un commentaire sur le changement de formule.
Ce qui intéressant d’étudier dans cet exemple précis, c’est le procédé utilisé pour assurer la transmission de cette information importante auprès des établissements, des patients, ainsi que sur la gouvernance de la prise de décision de ce changement.
Dans les mois qui ont suivis, après cette modification, les patients ont présenté un certain nombre d’effets indésirables, sans que l’ANSM ne réagisse avec diligence aux doléances des patients.
Certains médias s’autorisent à prendre le relais pour en faire état afin d’interpeller les autorités sanitaires sur cette situation préoccupante : « Des milliers de personnes atteintes de troubles de la thyroïde se plaignent d’effets indésirables depuis que la formule de leur médicament a changé. »
Les réclamations des patients ne se pas faites attendre : l’ANSM propose alors un procédé déclaratif complexe
Dès le début l’ANSM avait appelé à des mesures de précautions comme un dosage de TSH (thyréostimuline, hormone importante sécrétée par l’hypophyse pour stimuler la glande thyroïde) quelques semaines après le début de la prise de la nouvelle formule.
Mais, à la lecture de fiche questions/Réponses téléchargeable avec le communiqué, l’ANSM n’a absolument pas anticipé des effets indésirables spécifiques.
A la question « Quels sont les symptômes qui doivent m’alerter sur un déséquilibre thyroïdien ? » l’ANSM répond simplement que :
« Comme pour tout médicament, en cas d’évènement indésirable ou pour toute question relative à la prise du médicament, vous ne devez pas hésiter à consulter votre médecin. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration auprès de l ‘Agence nationale de sécurité du médicament et des produits de santé (ANSJW) et du réseau des Centres Régionaux de Pharmacovigilance, via le site internet de l’ANSM rubrique Déclarer un effet indésirable: http://ansm.sante.fr »
[NDLR : ce lien n’est pas le processus le plus direct pour arriver au portail de signalement !]
De nombreux effets indésirables pourtant décriés…. par les médias
La presse a fait état de plusieurs témoignages de patients et les forums de blogs et sites internet sont également alimentés par des retours d’expérience négatifs avec la nouvelle formule.
S’il y a manifestement, pour certains patients, une coïncidence entre le changement de formule et l’apparition d’effets indésirables, dans la majorité des cas, il y a probablement une corrélation, à défaut d’une causalité.
Les effets indésirables doivent être remontés au ministère de la santé sur le Portail de signalement des événements sanitaires indésirables.
Une pétition en faveur de l’ancienne formule du Lévothyrox
Une pétition a même été lancée pour revenir à l’ancienne formule. Elle s’adresse aux laboratoires fabriquant ce médicament ainsi qu’à l’Agence Nationale de Sécurité du Médicament (ANSM).
L’auteur de la pétition, dont le pseudo est Sylvielou, citée par Médicite, explique : « Trop de patients ne supportent pas le nouveau Lévothyrox® , ils ressentent d’importants effets secondaires« . Ainsi, les patients en colère souhaitent revenir à l’ancienne formule, car ils n’ont pas été consultés avant le changement de médicament.
En réalité, la demande de modification est diligentée par l’ANSM et non du laboratoire, contrairement à ce qu’affirme l’auteure de la pétition quand elle écrit « les laboratoires ont pris cette décision sans prendre l’avis des patients concernés. »
L’obstination de l’ANSM dans le maintien de ses recommandations, malgré l’augmentation des plaintes des patients
Si la nouvelle version a entraîné des protestations des patients le communiqué de l’ANSM a été mis à jour le 17 août 2017 pour actualiser la liste de questions-réponses et répondre ainsi aux patients.
La position de fermeté de l’ANSM dans les Q/R actualisées
Si quelques questions ont eu leur réponse reformulée (par exemple la question 2 pour préciser les changements de formule), trois questions ont été ajoutées.
Que faire si je prends des dosages différents avec une boîte de l’ancienne formule et une boîte de la nouvelle formule ?
Si vous n’avez pas d’autre choix, il est possible de « panacher » les boîtes (exemple : boite de Levothyrox 25 µg de l’ancienne formule et boite de Levothyrox 100 µg de la nouvelle formule), cependant il conviendra de vérifier la TSH en cas de symptômes alertant sur un déséquilibre thyroïdien.
Que faire en cas d’effets indésirables suite au passage à la nouvelle formule ?
Si vous ressentez des symptômes pouvant indiquer un déséquilibre thyroïdien, dans les semaines qui suivent votre passage à la nouvelle formule, et si ces symptômes perdurent, n’hésitez pas à consulter votre médecin, qui pourra vous prescrire un dosage des hormones thyroïdiennes 6 à 8 semaines après votre passage à la nouvelle formule, afin de pouvoir ajuster le dosage si nécessaire.
Si vous notez d’autres effets indésirables depuis ce changement et que ces symptômes perdurent, consultez votre médecin.
Vous pouvez, par ailleurs, déclarer tout effet indésirable suspecté d’être lié à un médicament sur le portail de déclaration du ministère en charge de la santé : signalement-sante.gouv.fr
Pourrait- on revenir à l’ancienne formule ou proposer les deux formules en parallèle ?
Le changement de formule est définitif, il n’y aura pas de retour à l’ancienne formule qui était de qualité inférieure à la nouvelle formule. En effet, des cas de dysfonctionnement thyroidien (hypo ou hyperthyroïdie) ont été observés avec l’ancienne formule en raison d’une teneur en principe actif qui pouvait varier au cours du temps.
Un réajustement posologique est parfois nécessaire avec la nouvelle formule mais l’équilibre une fois atteint sera maintenu.
Par ailleurs, la coexistence des deux formules sur le marché serait source de perturbation supplémentaire du bilan thyroïdien en cas de mélange de boîtes ou de stocks différents en fonction des pharmacies.
L’ANSM manque de transparence sur les signataires de cette nouvelle recommandation…. sur le cas du Lévothyrox
Il est étonnant que la fiche questions/réponses sur le Lévothyrox ne soit pas signée. L’auteur qui formule des affirmations ne s’identifie pas. Il y a juste le logo ANSM. Tous les écrits de l ’ANSM devraient être signés de leur(s) auteur(s)
Par ailleurs, il n’y a aucune traçabilité de la prise de décision du chargement de formule. Il eût été souhaitable de donner accès aux étapes, ce qui n’a pas été fait sur le communiqué du 02/03/2017. On ne sait pas finalement qui a décidé du changement et dans quelles conditions.
Au total personne ne semble nominativement responsable des décisions !!
L’ANSM devrait donc mieux encadrer sa politique de préconisations…dans l’intérêt des patients
Selon un rapport récent de l’Inspection Générale des Affaires Sociale, concernant l’audit de l’ANSM, celui-ci relatait déjà en 2015, la nécessité de renforcer ses prérogatives avec une régulationplus rigoureuse.
Pour conclure, le principe de précaution et de signalement reste donc primordial
Pour conclure, alors que le Lévothyrox, bien que perfectible dans sa forme initiale, a pu convenir pendant des décennies aux patients, on a réussi à les placer avec le produit d’origine du laboratoire Merck dans les mêmes incertitudes qu’il y a eu lorsque le générique était sorti, au point que le Lévothyrox a fait partie des rares médicaments non substituables, avec une période d’assouplissement lorsqu’il y avait eu une rupture de stock en 2013.
Mais l’Académie de médecine avait souligné « que la substitution rendue nécessaire par la pénurie soit mieux encadrée, car les préconisations de l’ANSM lui paraissent insuffisantes » et rappelé que le Lévothyrox est un médicament à marge thérapeutique étroite.
Enfin, l’Académie de médecine relevait que « Si de nombreux généralistes et endocrinologues prescrivent systématiquement le Lévothyrox sous la mention « non substituable », c’est que des éléments concordants les y incitent, dans l’intérêt de leurs patients » !
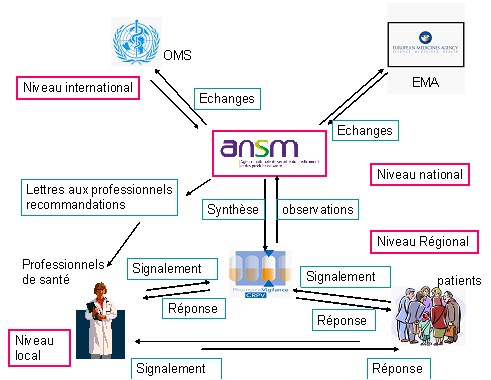
Gageons que sur le terrain les professionnels de santé et plus généralement ceux qui ont des responsabilités dans un établissement sanitaire ou médico-social (gestionnaire de risque, directeur d’EHPAD…), auront à cœur de veiller à l’intérêt des patients en appliquant plus que jamais les consignes de l’ANSM en matière de pharmacovigilance, en s’identifiant car cela leur est demandé sur le formulaire papier comme sur le portail de signalement :
l’ANSM écrit elle-même en gras « La pharmacovigilance repose sur le signalement, sans délai, par les professionnels de santé, des effets indésirables susceptibles d’être dus à un médicament.
Dès qu’ils soupçonnent un lien, même s’il n’est pas certain, une déclaration peut être effectuée auprès du centre régional de pharmacovigilance. »
Nous remercions vivement Jérôme Turquey (Dirigeant – SAS Qualitiges, Formateur dans le réseau Ad’Missons, Conseil en management et gouvernance, Ambassadeur Metz Métropole) , pour partager son expertise professionnelle en proposant de rédiger des articles sur le management de la qualité , pour nos fidèles lecteurs de www.managersante.com













3 réponses
On ne Peut pas eliminer un possible conflit d’interet entre un member de l’ansm et merck
Le changement n’était pas l’intérêt du laboratoire Merck qui était en situation de monopole son médicament étant largement prescrit non substituable. C’est la raison pour laquelle je suis dubitatif sur la plainte contre le labo. En revanche la nouvelle formule à la demande de l’ANSM donne au produit de Merck la même incertitude que les génériques pour les patients. La situation bénéficie donc plutôt à des concurrents de Merck pour redistribuer le marché de la lévothyroxine…
Levothyrox : face à la polémique, l’ANSM a mis en place ce jour un numéro vert http://bit.ly/2vfA47P