Nouvel article de notre experte, Aude BENOIT-CATTIN, consultante en Performance de la Qualité et des Processus, spécialiste de la Gestion des Projets de Recherche Clinique et de leur Plan de Continuité, experte certifiée Lean Six Sigma dans la Gestion des Risques, l’analyse des causes racines et le Plan CAPA*.
Elle accompagne la mise en place des référentiels Qualité dans l’Industrie Pharma depuis 2008, Responsable de la capitalisation des connaissances (Knowledge Management) et chargée de l’intégration et de la formation Qualité des fonctions Gestion de Projet au sein d’une CRO* Internationale d’envergure. Elle transfert aujourd’hui ses compétences de l’amélioration continue de la démarche Qualité au service des patients, ayant créé son cabinet Aude BConsultant en 2016.
(*) voir le glossaire disponible
N°2, Juillet 2020
En France, la crise sanitaire du COVID-19 est rentrée dans sa phase de réversibilité le 11 Mai, une phase orchestrée en trois étapes, se terminant le 22 Juin, jour de l’adoption du projet de loi clôturant la crise sanitaire (à l’exception de la Guyane et Mayotte), le 10 Juillet 2020. Dans le cadre de la mise en place du Ségur Santé, et plus largement des retours d’expérience requis par l’accréditation des établissements de santé en vigueur (V2014, en attente de la prochaine V2020 début 2021), j’ai souhaité mettre les pieds dans les chaussures d’un(e) Directeur Qualité / Gestion des Risques travaillant à l’hôpital ou au sein d’une clinique, responsable de cet exercice pour la première fois.
Le secteur de l’Industrie Pharmaceutique est hautement réglementé et dispose de référentiels harmonisés, notamment en ce qui concerne les études cliniques (en dehors de tout débat au sujet de la qualité et la pertinence des protocoles et des publications, qui n’est pas l’objet de cet article).
Cet article délivre une lecture croisée de référentiels et outils publics (HAS*, Ministères, ARS*) et des référentiels ICH/EMA* et ISO* sur trois des grands processus mobilisés dans la gestion de la connaissance : la gestion de projet, la gestion des risques qualité et la gestion de continuité d’activité. Il propose également quelques pistes de réflexion pour sécuriser la synergie des processus Qualité afin d’accompagner les acteurs dans leur vision globale de l’amélioration continue.
Est-ce que nous parlons tous le même langage REX ?
Avant toute chose, vérifier la définition du retour d’expérience (REX*) est un prérequis, pour assurer une collaboration qui commence par la même compréhension. L’environnement, par exemple réglementaire, diffère entre l’Industrie Pharmaceutique et l’hôpital, structure de soins publique, le premier environnement professionnel de l’auteur.
Dès les premières recherches, la multitude d’acronymes et de définitions étonne (REX, RETEX, CREX, REMED, ALARM, RMM, …*) sans bien savoir si finalement on parle de la même chose [1]. Le temps de lecture s’allonge en fonctions du nombre impressionnant de documents, comme le souligne l’interrogation d’un coordinateur de la Gestion des Risques à la Haute Autorité de Santé en Septembre 2012.
D’un point de vue Qualité, ce qui interpelle immédiatement, c’est que cet outil de « retour d’expérience » soit combiné à la gestion des Risques, qui plus est dans l’aspect de recherche des causes profondes, sans qu’une vision séquentielle du cycle Qualité soit exposée. D’un point de vue prédécesseur/successeur, la logique de l’amélioration continue dans sa globalité ne saute pas aux yeux, la gestion de projet encore moins.
Dans l’Industrie Pharmaceutique, deux normes s’appliquent : ICHQ9 Quality Risk Management (2006) [2] qui présente le concept de la Gestion Qualité Intégrée et le contrôle du changement et ICHQ10 Pharmaceutical Quality System (2008) [3] qui présente le système dans son ensemble, notamment le processus CAPA (Corrective Action Preventive Action) incluant l’analyse des causes et la gestion des connaissances (Knowledge Management).
Concernant la Gestion de Projet, la référence « classique » dans la gestion des études cliniques est celle du PMBOK* édité par l’Institut PMI (Project Management Institute) depuis plus de 50 ans, qui préconise le retour d’expérience régulier, y compris en fin de projet. La norme ISO 21500 « Lignes directrices sur le management de projet » parue en Octobre 2012 s’en inspire.
Source : Info Qualité
La HAS parle bien de retour d’expérience, mais y ajoute l’analyse des causes systémiques ou latentes [4] et se base sur les travaux du Professeur en Psychologie James Reason, notamment sur son article « Human error : models and management » publié au BJM* en 2000, ayant par ailleurs fait l’objet d’un papier de recherche des Mines ParisTech en Décembre 2014 [5]. Il se trouve que l’on parle bien de la gestion des erreurs à postériori [6] avec plusieurs sources d’information (REMED*, RMM*, CREX*).
Malheureusement, cette terminologie d’erreur humaine (traduction littérale) a un impact catastrophique sur la perception de la vocation et des bénéfices de la démarche Qualité.
Il est intéressant de noter qu’en 2011, la FDA* publia un Livre Blanc pour rappeler que les lacunes des formations n’étaient pas la réponse quasi systématique de l’investigation du « facteur humain » dans l’analyse des causes. Aujourd’hui la gestion de la Qualité et des Risques semble promouvoir la gestion des compétences comme un enjeu stratégique hospitalier, sujet partagé par la promotion Thomas Pesquet 2019 de l’EHESP*.
REX de crise versus REX standard, c’est pareil ?
Un projet implique des ressources, humaines et budgétaires, le retour d’expérience se planifie idéalement à la fin de chacune des phases d’un projet long (initiation, démarrage, maintenance et clôture). Dans le cas d’une gestion de crise qui nous occupe, le projet est court et fatigue les ressources dans un mode de gestion dégradée, le retour d’expérience ne se planifie qu’en sortie de crise, avec le recul suffisant.
D’un point de vue gestion d’une équipe projet embarquée dans la gestion de crise, le plan de continuité d’activité est défini (lorsqu’il existe) au niveau de la structure type entreprise (ici l’hôpital, la clinique, l’EHPAD*, la Croix Rouge …). Le seul bémol de ce retour d’expérience formule « structure », c’est qu’il exclut la vision globale des partenaires et typiquement, la gestion de crise sanitaire ne se limite pas à une structure puisque le centre en est le patient, qui suit un « parcours » (par exemple médecin généraliste, urgentiste/SAMU*, hôpital, transfert hospitalier/Armée, Soins de Suite, HAD*, généraliste). A noter que l’armée dispose de son processus de RETEX*, 13ème édition datant de Janvier 2017. A noter également que les transitions/transferts de responsabilités sont le siège bien connu des problèmes de Qualité dans tout projet, identifié dès la transmission au sein des postes infirmiers.
L’exercice REX* sera coordonné par un pilote, idéalement externe et neutre, qui anime des sessions et analyse les réponses à la recherche d’un signal d’alerte éventuel et cet exercice s’inscrit dans une séquence, comme le rappelle la Fédération des Organismes Régionaux pour l’Amélioration des Pratiques en établissement (FORAP*) [7]. La confiance est un facteur clé de succès, la libération de la parole est un exercice qui nécessite des valeurs personnelles fortes, le leadership du Chef de Projet, que l’on trouve plus facilement évoqué lorsque l’on parle de RETEX* que de REX* (voir ci-dessus).
Deux axes sont à évoquer dans un agenda de réunion/atelier REX* qui précise les temps de parole et qui assigne le rôle de gardien du temps (qui ne censure pas bien entendu, il rappelle le temps) : les expériences positives « ça marche » et les expériences négatives « ça ne marche pas » [8]. La construction du partage de l’information est basée sur un échange narratif « encadré » : Qui, quoi, quand, où et dans quelles circonstances, quelles bonnes pratiques promouvoir et quelles précautions proposer, à reproduire dans une situation identique ou similaire.
Dans un deuxième temps, l’analyse des données du REX* permet d’assimiler les points positifs à des Bonnes Pratiques, en l’absence de risque de dommage collatéral, il n’est pas question de déshabiller Paul pour habiller Jacques. Les points négatifs sont revus pour déterminer si la fréquence et la sévérité des impacts donnent lieu à une recherche de cause et un plan d’action (CAPA*) ou bien si les mesures immédiatement prises (corrections) ont été suffisantes dans le cadre de la gestion de crise. Dans cette gestion de crise, le terme « barrière » semble être la traduction des actions préventives appliquées préalablement à la survenue d’un problème, pour autant qu’il soit difficile de comprendre la formule « préventive à posteriori », opposable par définition sémantique.
Attention : une situation de crise donne lieu à la mise à jour du plan de continuité, les procédures de gestion standard ne sont pas systématiquement modifiées.
Idéalement, les informations issues du REX* sont accessibles dans un base de données à l’usage des Représentant Qualité et des Cadres (de Soins, Ingénieur Biomédical, Pharmacien Responsable etc …). Ces données alimentent le Cycle de Vie Qualité, au même titre que les autres sources d’information provenant de différentes mesures d’indicateurs par exemple.
Comment utiliser le REX dans la revue des processus ?
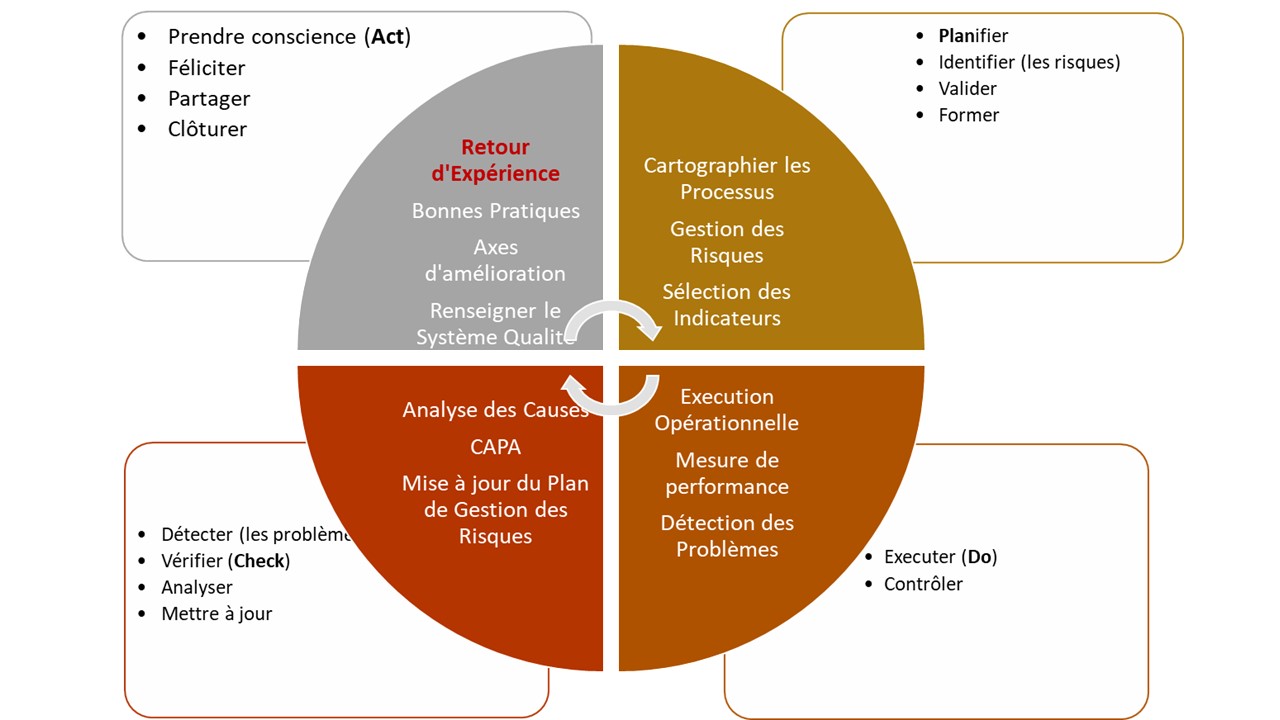
L’amélioration continue est basée sur un Cycle de Vie de la Qualité intitulé PDCA* (également partie de la méthodologie Lean, alors intitulé DMAIC*) qui intègre les différents composants, cycle logique qui permet d’apprendre des défaillances d’un processus de gestion opéré par des acteurs multiples qui constituent la chaîne de valeurs. Il ne s’agit donc pas de « mettre en cause un acteur de la procédure » mais d’augmenter la capacité d’une procédure à délivrer sa valeur et à satisfaire les utilisateurs et les clients. L’un des enjeux est de promouvoir la Qualité, de sortir de la notion de blâme, en utilisant un vocabulaire approprié.
La SoFGRES*, membre de la Fédération française des Associations en Qualité Sécurité en Santé (FAQSS) avait proposé il y a environ un an un atelier sur la gestion des événements indésirables, rappelant l’importance de la culture Qualité, le sens d’apprendre de ses erreurs, s’interrogeant notamment sur « comment promouvoir le signalement des évènements indésirables graves avec un retour d’expérience » : Le Ségur de Santé a-t-il donné l’occasion de présenter les Bonnes Pratiques facilitant la déclaration des évènements indésirables en période de crise sanitaire, sur la base de l’expérience acquise ?
Dans l’Industrie Pharma, la norme ICHQ9 (en cours de révision) clarifie les méthodologies de gestion des risques, incluant notamment le AMDEC* (Analyse des Modes de Défaillance, de leurs Effets et de leur Criticité) qui se base sur les processus sur lesquels toute activité repose. Comme le rappelle la HAS, un risque trouve sa source directement dans le processus de gestion dont on analyse les points critiques [9] au moyen d’un outil de gestion des risques, tel que l’AMDE* [10], l’HAS n’y inclut pas l’évaluation de la criticité.
Plusieurs sources d’information alimentent la détection des problèmes Qualité : la plainte (des usagers/patients/clients), les visiteurs, les patients-traceurs, les audits internes, les inspections (évaluation), les revues Qualité et …et les REX. Chaque signal provenant d’une source différente affecte un ou plusieurs processus de gestion, c’est donc la somme des signaux qu’il faudra considérer, ramenée à un processus, voir idéalement une étape d’un processus.
Chaque processus comporte des risques, ceux liés aux événements indésirables sont d’intérêt car ils existent en Recherche Clinique comme dans la gestion des soins hors protocole d’études cliniques, et leur processus de gestion fait l’objet d’une surveillance réglementaire, comme le rappelle un récent article du Clinical Leader.
A titre individuel, un événement indésirable est attendu, c’est-à-dire qu’il est impossible qu’il ne s’en produise pas. Il dispose d’une procédure de gestion, en premier lieu il s’agit de savoir s’il est grave ou non. La défaillance dans l’exécution de cette procédure est un risque, renseigné dans un Plan de Gestion des Risques. La réalisation de ce risque est un problème qui peut vite faire débat [11] d’où l’importance de bien porter son attention sur les risques des processus. La gestion des EI/EIG* et des déviations de protocole d’études cliniques fonctionne de la même façon, à noter qu’une violation grave doit être notifiée dans les 7 jours [12].
Pour résumer, le cycle PDCA* démarre avec la planification d’un cycle de gestion, il ne débute pas par un contrôle ou un bilan, cette phase correspond à la phase de vérification (le « C » – Check du cycle).
Aude Bconsultant © – Démarche d’Amélioration de la Qualité Globale
Quelques Bonnes Pratiques :
- Un risque ne s’est pas encore produit, lorsqu’il se produit il devient un problème,
- Un risque peut être accepté, avec ou sans mesure de réduction, néanmoins il est surveillé suivant la criticité de son impact, s’il vient à se réaliser, le risque est clôturé,
- Tout problème Qualité nécessite une correction immédiate pour contenir l’impact, si le problème était identifié comme un risque inacceptable, il dispose de mesures d’urgence connues et applicables,
- Un problème Qualité isolé ne requiert pas d’analyse des causes profondes systématique, c’est la fréquence de survenue conjuguée à la sévérité de l’impact (notamment sur la sécurité des patients) qui impose la recherche de cause racine/profonde dans le but de corriger la source du problème,
- Une cause racine peut être la source de plusieurs problèmes Qualité, y compris ceux qui ne se sont pas encore produits (risques),
- Le plan CAPA* est une liste d’actions comprenant une date prévue de réalisation et une date de clôture, l’efficacité de ces actions doit être évaluée pour garantir la robustesse du processus,
- Les retours d’expérience sont le point de clôture et d’ouverture d’un projet, l’occasion d’améliorer le cycle suivant.
Le cycle de vie du Système Qualité sera modifié par la certification V2020, plus robuste d’après la présentation proposée en Octobre dernier par la HAS « « Qualité et sécurité en santé, s’adapter: un challenge pour les usagers et les professionnels« . Plusieurs REX ont sans doute alimenté cette mise à jour, notamment le retour d’expérience sur l’articulation V2010-2014 [13] et celui des premiers Compte Qualité disponible depuis Janvier 2016 [14].
Le REX : une des pistes d’amélioration Qualité au service du Patient ?
Le risque prenant sa source dans le processus, la rédaction est le premier pilier de simplification, celle ou le Lean Management peut servir de base de travail. Et pour faciliter l’adhésion, il est souhaitable de considérer la synergie Qualité/Opérations sur un modèle de co-construction. La Qualité doit maîtriser deux compétences clés : la connaissance des référentiels et la capacité à opérationnaliser les obligations dans des procédures simples. Par exemple, la Politique d’Amélioration de Qualité et de la Sécurité des Soins (PAQSS*) se décline dans un Plan dont le format n’est pas standard, pas plus que le programme d’actions du Compte Qualité, même si 11 thématiques sont obligatoires [15], la notion de processus n’est pas homogène. La continuité d’activité en période de crise pourrait bien faire son entrée dans les thématiques obligatoires.
Cartographier une chaîne de valeurs avec les responsabilités des acteurs principaux est une base de performance : l’objectif est une vision claire d’un effort collectif du début à la fin d’une activité définie, c’est tout de même plus simple pour assurer des relais. Cette activité implique obligatoirement un effort de synthèse (une page) et une clarification des rôles et responsabilités des fonctions clés (5/6 fonctions, 10/15 étapes). Finalement, la Qualité est une habitude à promouvoir, le compte Qualité peut-il devenir un outil de cohésion collective plutôt qu’un document de préparation et de suivi d’inspection ? Une base de connaissance se gère dans le temps, les REX* ne sont pas tous valables ad vitam aeternam, notamment lorsqu’un changement majeur intervient dans le système. Prenons l’exemple de la « méthodologie de retour d’expérience pour les événements sanitaires ou à impact sanitaire » publiée par la Direction Générale de la Santé en 2007 [16], on consulte notamment les recommandations (page 46 à 50) et les préconisations de rédaction des retours d’expérience page 51. Ou encore le RETEX* du Ministère de l’Intérieur (ORSEC) publié en 2013 [17], page 24-25.
L’atelier « pourquoi, quand et comment organiser un retour d’expérience » du 7 Juin 2016 proposé par Santé Publique France a donné lieu à l’édition d’un document complet [18] on note cinq processus pour devenir une organisation pleinement consciente.
En Juin, le Conseil EHESP* a édité des pistes de réflexions (154 pages quand même) pour adapter les organisations face à la permanence du risque [19], la première piste n’est-elle pas de considérer qu’un plan de continuité permet de limiter la brutalité, d’accompagner proactivement l’adaptation et la résilience plutôt que de rédiger un plan réactif dans l’urgence ? La réactivité (a posteriori) a un coût financier non contrôlé, une démarche rarement sécurisée, y compris dans la rédaction des diverses documents au pied levé, sans circuit de révision pour garantir la qualité avant la publication, provoquant des dommages collatéraux liés au manque de robustesse de la conduite du changement.
Considérer la gestion du changement que cette crise sanitaire va provoquer au niveau des structures de soins, et la gestion documentaire qui s’y rattache est un pilotage Qualité dont le REX* est une étape charnière, entre la sortie de crise et la revue des processus clés.
Pour conclure, aller plus loin et établir une démarche
Frédéric Spinhirny rappelle, dans son article publié sur la plateforme ManagerSante.com, que « constituer une expérience sur la base d’une synthèse narrative est une clé d’engagement et de motivation qui donne du sens ». Au-delà du REX* c’est la culture de la qualité et la performance qu’elle offrira (ou pas) qui signera la réussite de cette sortie de crise, faisant de cette situation sans précédent une opportunité d’amélioration du management des organisations de santé et de ses partenaires stratégiques.
La qualité réside dans chaque opérateur (interne et externe) de la chaîne de valeurs, de la rédaction d’une offre d’emploi à l’intégration d’une ressource, en passant par toutes les étapes opérationnelles qui produisent un service global. Simplifier commence par le fait de partager des définitions simples, harmonisées non seulement dans chaque établissement, public ou privé, mais mieux encore au niveau régional, national voir – soyons fous – européen et international.
(crédit photo – freepix)
Les problèmes sont incontournables, isolés ou systémiques, certains sont issus de la réalisation d’un risque, d’autres sont naïfs, et c’est très différent. Les mises à jour de la procédure ISO 9001 (2015) et GCP*-ICH E6R2 (2016) relative aux études cliniques sont fortement axées sur la gestion du risque, notamment celles qui incombent aux Promoteurs des Essais Cliniques, pouvant d’ailleurs être des institutionnels, autrement dit des établissements de Santé Publique ou Privée en France.
L’inconscient collectif peine à donner du sens aux procédures qualités pourtant fédératrices, peut-être parce que la notion de contrôle (voir de punition) reste fortement prioritaire, au détriment des bénéfices opérationnels, humains et de fait financiers d’une démarche qui doit pourtant rapidement s’améliorer pour répondre aux attentes du client final – le patient – et des acteurs qui produisent sa valeur ajoutée au quotidien.
Glossaire utile pour parler et comprendre le même langage
| Acronyme | Intitulé |
| ALARM | Association of Litigation and Risk Management |
| AMDE | Analyse des Modes de Défaillance et de leurs Effets |
| AMDEC | Analyse des Modes de Défaillance, de leurs Effets et de leur Criticité |
| ARS | Agence Régionale de Santé |
| BJM | British Journal of Management |
| CAPA | Corrective Action Preventive Action |
| CREX | Comité de Retour d’EXpérience |
| CRO | Contract Research Organization |
| DMAIC | Define – Mesure – Analyse – Improve – Control |
| EHESP | Ecole des Hautes Etudes en Santé Publique |
| EHPAD | Etablissement d’Hébergement pour Personnes Agées Dépendantes |
| EI/EIG | Evènement Indésirable / Evènement Indésirable Grave |
| EMA | European Medicines Agency |
| FDA | U.S Food and Drug Administration |
| FORAP | Fédération des Organismes Régionaux pour l’Amélioration des Pratiques en établissement |
| GCP | Good Clinical Practices |
| HAS | Haute Autorité de Santé |
| HAD | Hospitalisation A Domicile |
| ICH | International Council for Harmonisation |
| ISO | International Organization for Standardization |
| PAQSS | Programme d’Amélioration de la Qualité et de la Sécurité des Soins |
| PDCA | Plan – Do – Check – Act |
| REMED | Revue des Erreurs liées aux Médicaments et Dispositifs associés |
| REX | Retour d’EXpérience |
| RETEX | RETour d’EXpérience |
| RMM | Revue de Mortalité-Morbidité |
| SAMU | Service d’Aide Médicale d’Urgence |
Le mois prochain découvrez un nouvel article de notre experte, Aude BENOIT-CATTIN, qui portera sur le thème : « Gouvernance de la Qualité : similitudes et différences entre le contrôle et l’Assurance Qualité ».
Pour aller plus loin :
[1] HAS – Retour d’expérience en santé (REX) : Comprendre et mettre en œuvre (2014]
[2] ICH Q9 – Quality Risk Management
[3] ICH Q10 – Pharmaceutical Quality System
[4] Article HAS Novembre 2013 « Causes systémiques ou latentes des événements indésirables associés aux soins »
[5] HAL – Le modèle de l’erreur humaine de James Reason
[6] HAS – Auto-évaluation administration des médicaments – Partie 3 Boîte à outils > Boîte 3
[7] Fédération des Organismes Régionaux pour l’Amélioration des Pratiques en établissement – les mémos de la FORAP « Etapes de sortie de crise COVID-19″
[8] EMA – Regulatory Science Strategy to 2025 (endorsed by EMA’s Management Board)
Page 11 « Some responses highlighted that the strategy should be based on a clear analysis of what works well, and then take a more proactive approach to changing what does not, so that lessons learnt are implemented in the strategy.”
[9] HAS – Fiche 25. Analyse de processus 25 et de ses points critiques
[10] HAS – Fiche 26. Analyse des modes de défaillances et de leurs effets (AMDE)
[11] Communiqué de presse du CHU de Toulouse (6 avril 2018)
[12] EMA – Draft Guideline for the notification of serious breaches (en cours)
[13] HAS – Certification V2010 – V2014 Retour d’expérience sur le processus décisionnel V2010 et articulation avec la V2014 (Avril 2015)
[14] HAS – Certification V2014 Retour d’expérience sur les premiers Comptes Qualité (Janvier 2016)
[15] HAS – Guide méthodologique Compte Qualité V14 (validé le 11 Octobre 2018)
[16] Direction générale de la Santé Département des situations d’urgence sanitaire (Desus) Méthodologie de retour d’expérience pour les événements sanitaires ou à impact sanitaire mars (2007)
[17] Ministère de l’Intérieur – RETEX Retour d’Expériences – Synthèse 2013
[18] Pourquoi, quand et comment organiser un retour d’expérience ? Rencontre de Santé Publique France > atelier du mardi 7 juin 2016
[19] EHESP Conseil « COVID-19 : pistes de réflexions pour adapter les organisations face à la permanence du risque »
Nous remercions vivement Aude BENOIT-CATTIN, Consultante en Performance de la Qualité et des Processus, Spécialiste en Recherche et Développement, notamment en Recherche Clinique, diplômée d’un MBA International Finance-Audit, Certifiée Lean Six Sigma et fondatrice du cabinet Aude Bconsultant en 2016, de partager son expertise professionnelle en proposant ses publications mensuelles, pour nos fidèles lecteurs de ManagerSante.com
Biographie de l’auteure :
Aude BENOIT-CATTIN est Fondatrice du Cabinet de Conseils Aude BConsultant, Directeur Qualité de Transition et Consultant en Performance des Organisations, par ailleurs membre associé de France Biotech. Diplômée d’un Master International en Administration des Affaires (MBA spécialisation Audit/Finance), Diplômée du Centre d’Enseignement de la Statistique à la Santé Publique, à la Médecine et à la Biologie (CESAM) et certifiée Lean Six Sigma sur le thème de l’amélioration de la gestion des risques opérationnels en Recherche Clinique. Elle est également Infirmière Diplômée d’Etat, vocation initiale qui l’a conduite à s’orienter vers le management des organisations, la gestion de projet et finalement la Qualité et l’optimisation des processus de gestion.
Sa carrière s’exerce dans les Industries de Santé, au sein de la Recherche Clinique chez les grands promoteurs privés (Pharma), chez leurs prestataires de services (CRO Internationales) et auprès des investigateurs, notamment auprès des Centres d’Investigation Institutionnels en charge de l’application des protocoles de Recherche Clinique.
En 2008, elle rejoint la Qualité Globale et met en place les référentiels internationaux du Système Qualité et de la Gestion des Risques Qualité, fondamentaux de l’Amélioration Continue. Elle devient référente en Gestion de la Continuité d’Activité, Experte en analyse des causes et Plan CAPA et contribue à l’optimisation des processus, des indicateurs et des systèmes utilisés par les acteurs pharmaceutiques du conglomérat Transcelerate.
[OUVRAGE DISPONIBLE]
Plusieurs experts de MANAGERSANTE.COM
publient chez notre partenaire,
les éditions du Groupe LEH
_____________
Les Editions Hospitalières propose une publication disponible depuis le 15 Février 2020, rédigée par plusieurs auteurs consacré à la « Qualité et sécurité en établissement de santé », un ouvrage de référence concret d’expériences d’acteurs de santé confrontés au jour le jour à des organisations managériales partiellement sécurisées.
[DÉCOUVREZ NOTRE NOUVELLE CHAÎNE YOUTUBE]
youtube.com/c/ManagerSante
Et suivez l’actualité sur ManagerSante.com,